PUBMED ОБЗОР: Исследование способов лечения келоидных и гипертрофических рубцов
Кожа является защитным барьером организма от факторов внешней среды. Рубцы возникают в результате ее механических повреждений, ожогов, хирургических вмешательств, воздействия химических или биологических агентов и длительных дерматологических заболеваний.
В результате нормального заживления ран образуется правильный, плоский, светлый и эластичный шрам. Нормальные рубцы не выходят за пределы первоначальной области повреждения и являются эстетически удовлетворительными.
К патологическим рубцам относят гипертрофические рубцы, келоидные образования и атрофические рубцы. Среди факторов, повышающих риск патологического рубцевания, можно выделить: возраст, анатомическое расположение раны, расу и тип травмы [8].
Подробно про гипертрофические и келоидные рубцы мы рассказывали в статье «Без изъянов: терапия патологических рубцов».
Напомним, что:
Гипертрофические рубцы представляют собой узлы куполообразной формы различных размеров (от мелких до очень крупных), с гладкой или бугристой поверхностью.
В развитии гипертрофических рубцов основную роль играет нарушение метаболизма внеклеточного матрикса вновь синтезированной соединительной ткани: гиперпродукция и нарушение процессов ремоделирования межклеточного матрикса с повышенной экспрессией коллагена I и III типов. Кроме того, нарушение системы гемостаза способствует избыточной неоваскуляризации и увеличивает время реэпителизации.
Келоидные рубцы представляют собой четко очерченные плотные узлы или бляшки, от розового до лилового цвета, с гладкой поверхностью и неравномерными нечеткими границами.
Ключевую роль в формировании келоидного рубца играют аномальные фибробласты и трансформирующий фактор роста - β1. Кроме того, в тканях келоидных рубцов определяется увеличение числа тучных клеток, ассоциированных с повышенным уровнем таких промоторов фиброза, как индуцируемый гипоксией фактор-1α, сосудистый эндотелиальный фактор роста и ингибитор активатора плазминогена-1.
В данной статье проанализируем обзоры современных методов лечения патологических рубцов, представленных в базе данных по биомедицинским исследованиям PubMed.
Патомеханизмы развития гипертрофических рубцов и келоидов [9]
За последнее десятилетие ученые значительно расширили наше понимание того, как развиваются и прогрессируют гипертрофические рубцы (ГР)и келоиды.
Аномальный рост этих рубцов обусловлен хроническим воспалением в ретикулярной дерме. При этом, рубцы, которые спонтанно теряют это кожное воспаление с течением времени, определяются как гипертрофические, тогда как рубцы с длительным воспалением определяются как келоиды. Эта разница в продолжительности воспаления и объясняет несопоставимые особенности роста ГР и келоидов. Именно из-за ослабевания воспаления, ГР не выходят за границы первоначальной раны. Напротив, непрерывное, усиливающееся воспаление келоидов приводит к их врастанию в прилегающую нормальную кожу.
С точки зрения гистопатологии, воспаление и, как следствие, накопление внеклеточного матрикса со временем приводят к образованию кожных утолщений и толстых эозинофильных (гиалинизирующих) коллагеновых пучков, называемых “келоидным коллагеном” (коллаген типа III (ранний), либо типа I (поздний)).
Если кожное утолщение является основным гистологическим симптомом, рубец диагностируется как гипертрофический. Это говорит о том, что келоиды/ГР являются проявлениями одного и того же воспалительного фибропролиферативного состояния и просто отличаются интенсивностью и продолжительностью воспаления.
Форма келоида в значительной степени определяется направлением натяжения кожи вокруг места раны/рубца. Также келоиды особенно распространены на участках тела сопряженными с периодическим сильным натяжением кожи из-за движений тела, таких как суставы, передняя часть шеи, грудная клетка, лопатка/предплечье и надлобковая область.
Факторы риска [10]
Помимо пациентов с келоидами и ГР в анамнезе, угрозе образования данных видов патологических рубцов подвержены пациенты, находящиеся в следующих группах риска:
Локализация рубца. Как мы уже писали, ГР и келоиды чаще всего возникают на участках тела сопряженными с периодическим сильным натяжением кожи из-за движений тела. Реже всего они появляются на волосистой части головы и передней части голени, где растяжение невелико. Это связано с тем, что растяжение раны затягивает и усугубляет ее воспаление, тем самым провоцируя гипертрофический рубец и образование келоидов.
Для предотвращения образования гипертрофических рубцов и келоидных образований после операций на чувствительных участках тела следует пользоваться фиксирующими материалами, такими как бумажными или силиконовыми лентами для швов, гидрогелевыми пластырями, компрессионными бинтами и специальным бельем.
Польза данных продуктов подтверждается метаанализами / рандомизированными контролируемыми исследованиями. Так, использование бумажной ленты снижает риск развития гипертрофических рубцов после кесарева сечения в 13,6 раза.
Метаанализ 20 исследований использования гелевых пластырей показал, что они могут предотвращать образование гипертрофических рубцов и келоидных образований у склонных к образованию рубцов людей с недавно зажившими ранами; однако авторы метаанализа отметили, что качество исследований не было высоким.
O'Brien L., Jones D. J. Silicone gel sheeting for preventing and treating hypertrophic and keloid scars //Cochrane database of systematic reviews. – 2013. – №. 9.
Выявлено, что использование силиконового геля, например, уменьшает пигментацию шрама после стернотомии, эритему, жесткость, высоту, а также боль и зуд
Что касается компрессионной терапии, то метаанализ 12 исследований подтвердил, что компрессионная терапия при давлении от 15 до 25 мм рт. ст. уменьшает толщину ожогового рубца, эритему и жесткость рубцовой ткани.
Системные факторы. В первую очередь, к системным факторам относится количество в организме женского гормона – эстрогена. Так, в исследовании 2019 года Noishiki et al. было показано, что у женщин чаще образуются келоиды. Более того, вызванная эстрогенами вазодилатация может усугубить воспаление ран и рубцов: действительно, вероятность появления ГР и келоидов усиливается во время беременности и уменьшается после родов.
Еще одним системным фактором является артериальная гипертензия, которая может усугублять гипертрофические рубцы и келоиды. Также, аутоимунные заболевания могут значительно усугубить гипертрофические рубцы и келоиды.
Генетика. Формирование келоидных рубцов в значительной степени обусловлены генетикой. Это частично объясняет этнические различия в восприимчивости к образованию келоидов: келоиды распространены у африканцев (поражаются от 5 до 10%), реже у азиатов (от 0,1 до 1%) и редко у европейцев / североамериканцев (<0,1%).
Известно, несколько однонуклеотидных полиморфизмов, ассоциирующихся с келоидами: четыре способствуют келоидогенезу и один ассоциируется с тяжелыми келоидами.
Несколько генетических заболеваний связаны с келоидогенезом, включая синдром Рубинштейна-Тайби: AL Van de Kar, 2019 сообщает, что у 24 процентов таких пациентов были обнаружены спонтанно растущие келоиды. В исследовании Hosalkar, 2007 была продемонстрирована связь между множественными наследственными экзостозами и келоидогенезом.
Образ жизни. Несколько факторов образа жизни могут усугубить воспаление ран и рубцов, например, интенсивная физическая активность. Также Ogawa, 2022 сообщает, что пациенты часто могут испытывать зуд и боль после употребления горячей пищи или принятия ванны.
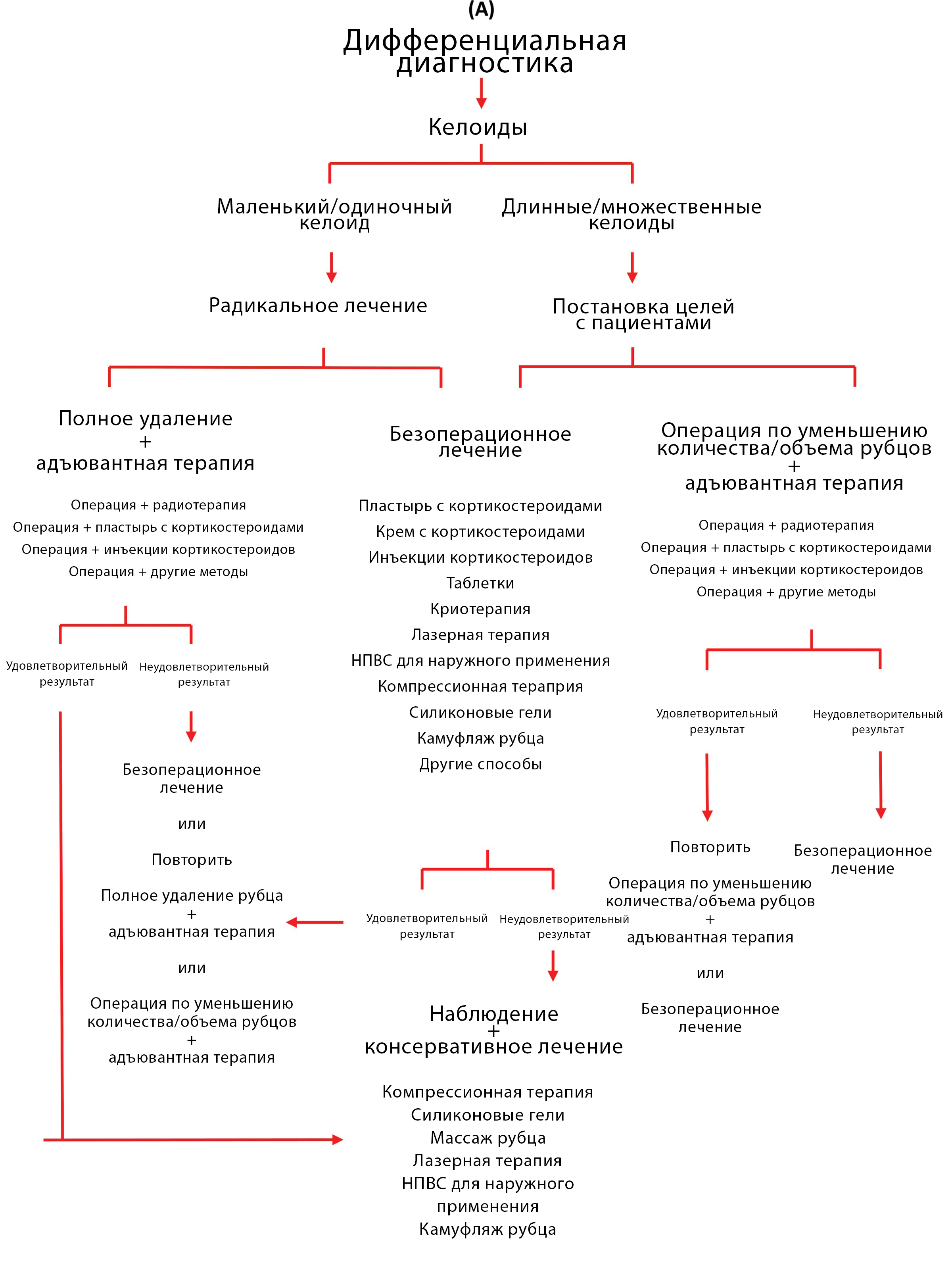
Лечение гипертрофических рубцов и келоидов
Ogawa, 2022 [10] предложил обновленные схемы лечения ГР и келоидов.
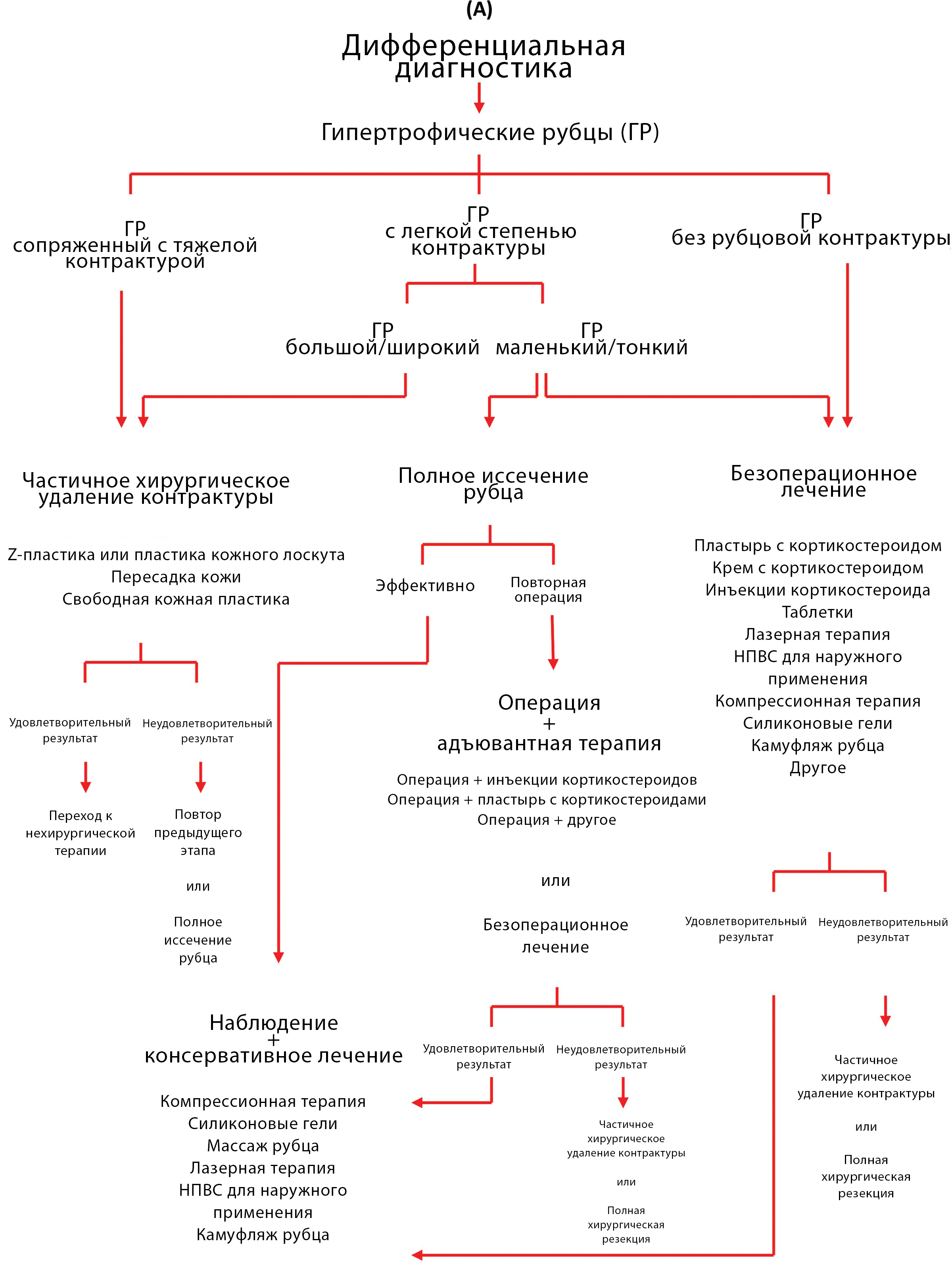
Пластыри с кортикостероидами (депродона пропионат) доступны только в Японии. Автор также рекомендует флудроксикортидную ленту, к сожалению, такая лента не распространяется в РФ.
Введение кортикостероидов
Согласно систематическому обзору 2023 года [16], самым популярным нехирургическим методом лечения патологических рубцов является внтурирубцовое введение кортикостероидов. Самым распространенным и самым изученным является триамцинолона ацетонид (ТА) – синтетический кортикостероид. Препарат вызывает регрессию келоидов и ГР посредством механизмов подавления воспаления кожи, уменьшения доставки кислорода к ложу раны за счет сужения сосудов и антимитотическую активность кератиноцитов и фибробластов.
В исследованной литературе [15] он вводился в дозе от 10 до 40 мг/мл. В 8 из 16 исследований изучались инъекции 20-40 мг/мл. Примечательно, что исследование Huu et al. сравнило количество введенного ТА на площадь рубца в дозах 7,5 и 14 мг / см2 и выявило больше удовлетворительных результатов в группе с меньшей дозировкой; однако размер и характеристики изученных келоидов не были указаны.
Частота процедур варьировалась от разовых инъекций до еженедельных и ежемесячных инъекций. Так, Aluko-Olokun et al. (2016) изучали оптимальную дозировку TA и наблюдали лучшее уменьшение объема келоидов при 2-недельных интервалах лечения.
К побочным явлениям инъекций кортикостероидов относят боль, системные побочные эффекты (например, нарушение менструального цикла, угнетение коры надпочечников, а также катаракта и глаукома) и местные побочные эффекты (например, истончение и атрофия кожи, стероидные акне, расширение капилляров и гипопигментация) [11].
Ogawa, 2020 [9] рекомендует следующий протокол применения ТА:
- в одном шприце должна содержаться доза 5-10 мг. + 1% анестетика и адреналина. При дозе 5 мг и меньше уменьшается вероятность возникновения нарушений менструального цикла у женщин;
- размер игл 27 или 30G;
- в первую очередь, необходимо обколоть границы рубца, там, где он соприкасается со здоровой кожей: игла не должна проникать глубоко, чтобы воздействовать на воспаленные края рубца.
- инъецировать препарат в сердцевину рубца без подготовки не стоит, так как ткань в этом месте особенно плотная, а это не даст лекарству распределиться. Необходимо сначала размягчить шрам продольными инъекциями от края рубца к центру, более глубокие слои рубцовой ткани – мягче.
- небольшие келоиды могут уже значительно уменьшится спустя 1-2 инъекции.
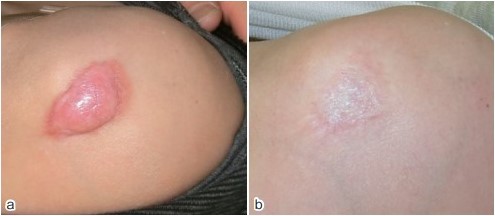
Рисунок 1. Келоид на правом плече пациентки 50 лет вылечен инъекциями ТА [12]:
а) Перед началом лечения;
b) Через 24 месяца после начала лечения (вводили 5 мг ТА с 1% ксилокаином с адреналином, каждые 2-3 месяца)
Для увеличения эффективности ТА и снижения его побочных эффектов, его применяют в смеси с 5-Фторурацилом (5-ФУ).
5-Фторурацил - противоопухолевый препарат из группы антиметаболитов, антагонистов пиримидинов.
Однако применение 5‐ФУ может быть поставлено под сомнение, поскольку системный прием 5‐ФУ может вызывать анемию, лейкопению и тромбоцитопению[13].
В мета-анализе [13] рассматривались 4 исследования, в которых сравнивали группы пациентов, получавших монотерапию ТА и сочетанную терапию ТА+5-ФУ.
В 3 исследованиях контрольная группа получала внутрирубцовые инъекции 10 мг ТА один раз в неделю в течение 8 сеансов, а экспериментальная – 4 мг ТА в смеси с 45 мг 5-ФУ, также раз в неделю в течение 8 процедур. В 4 исследовании контрольная группа получала 20 мг ТА 4 раза в неделю в течение 6 сеансов, а экспериментальная – 1 мг ТА в смеси с 45 мг 5-ФУ 2 раза в неделю в течение 10 процедур.
Продолжительность исследований составила от 12 до 32 недель.
Результаты исследований показали‐ что 5-FU подавляет келоиды и гипертрофические рубцы благодаря своему воздействию на антиангиогенез, синтез коллагена, ингибирование клеточной пролиферации и апоптоз фибробластов. Анализ чувствительности подтвердил стабильность результатов. Кроме того, после применения TAC и 5-FU наблюдалось меньше побочных эффектов.
Результаты мета-анализа [5] подтверждают лучшие результаты на сочетанном применении ТА+5-ФУ: средняя высота рубца и показатель эритемы в группе TA + 5-ФУ были ниже, чем в группе TA после лечения (P < 0,05). Эффективность, основанная на оценке наблюдателем после лечения в группе TA + 5-ФУ, была выше, чем в группе TA (P < 0,05); кроме того, анализ подгрупп показал, что группа TA + 5-ФУ также превосходила группу TA в лечении ГР (P = 0,01), и не было существенных различий в лечении келоидных рубцов (P = 0,12). Эффективность, основанная на самооценке пациента после лечения, в группе TA + 5-ФУ была выше, чем в группе TA (P < 0,05). Общая частота осложнений в группе TA + 5-ФУ была ниже, чем в группе (P < 0,05).
В систематическом обзоре [13] делается вывод, что комбинация 5-Фторурацила и триамцинолона (в разведении 9:1) оказалась лучшей среди внутрирубцовых методов лечения келоидов
В статье [8] для лечения келоидов и ГР предлагают смешивать ТА с блеомицином. В данном исследовании с июня 2012 года по август 2020 года приняли участие в общей сложности 86 пациентов с келоидными рубцами. Возраст от 7 до 72 лет. Было 35 мужчин и 51 женщина.
Блеомицин - противоопухолевый препарат, который эффективно нарушает синтез ДНК в пролиферирующих клетках. Он клинически используется для лечения злокачественных опухолей, гемангиом и других заболеваний
В протоколах терапии использовался блеомицин 15 000 ед. производства Freycifers Pharmaceuticals Co., Ltd., 15 000 единиц, ТА производства Zhejiang Xianju Pharmaceutical 50 мг /5 мл.
Протокол: Ввести препарат в рубец с помощью шприца объемом 1 мл. Блеомицин используется в разведении с физраствором в дозе 0,05 млн ед/см2, а ТА в разведении с физраствором 5 мг/см2. При инъекционном введении препарата необходимо особое внимание уделить основанию келоида, чтобы блеомицин мог снизтть кровоснабжение, подавляя рост келоида и способствуя его атрофии.
При инъекционном введении лекарств препарат вводится радиально, а расстояние между инъекциями препарата составляет менее 0,3 см, чтобы лекарство максимально равномерно распределялось в рубцовой ткани.
Интервал лечения определяется в зависимости от состояния рубцовой гиперплазии и размера рубца. Если рубец темно-красный, плотный и блестящий на интервал между процедурами составляет 2 недели. Если рубец красноватый и имеет текстуру кожи на поверхности, можно увеличить интервал до 4 недель. Из-за ограничения дозы препаратов лечение крупных келоидов может быть не окончено за 1 день. Процедуру можно делать 3 дня подряд, чтобы полностью покрыть келоид, а весь курс лечения можно повторить через 3-4 недели.
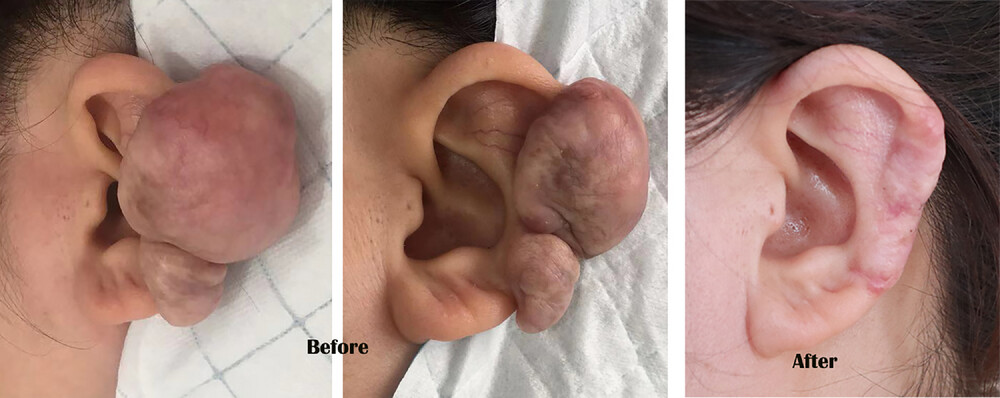
Рисунок 2[8]. Келоидный рубец на левом ухе. После лечения блеомицином и ТА эритема регрессировала, келоид изменился с твердого на мягкий, а поверхность келоида стала морщинистой. Была проведена реконструкция уха, форма наружного уха в основном нормализовалась. В течение следующих 2 лет наблюдения рубец оставался стабильным и не рецидивировал.
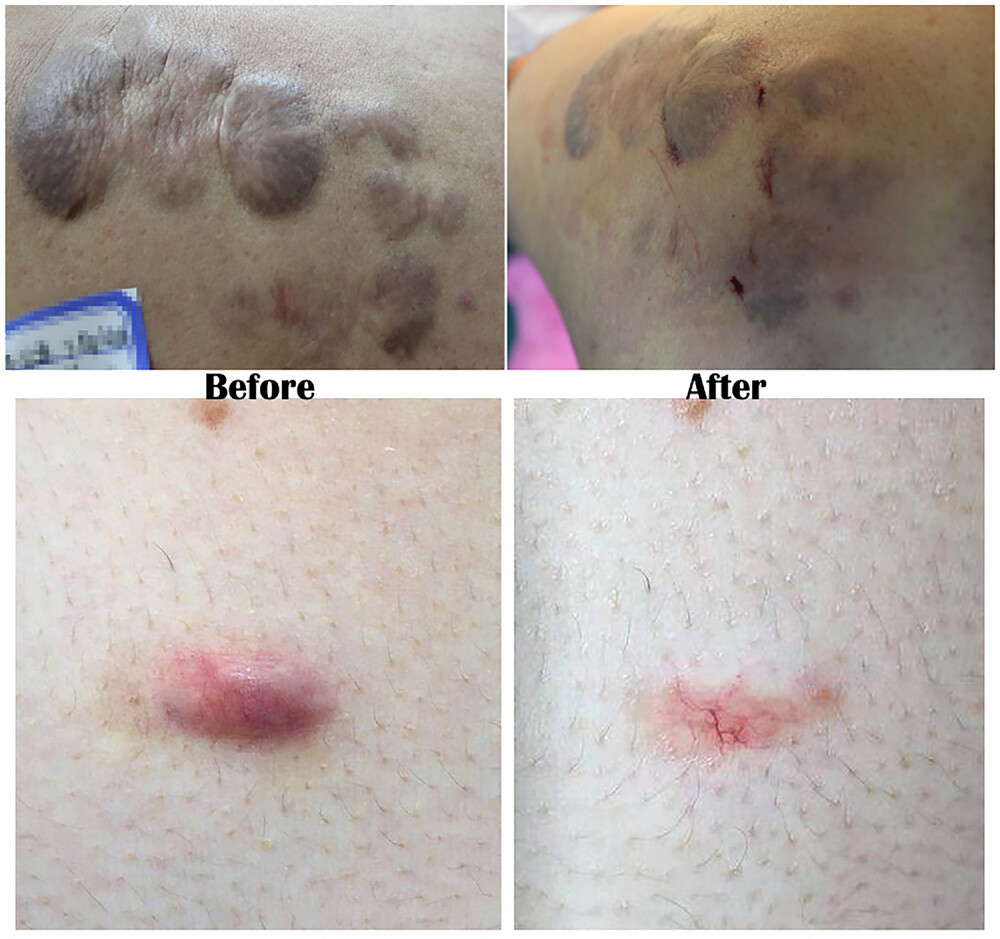
Рисунок 3[8]. Келоидные образования на правой лопатке и грудной клетке до лечения были заметно приподнятыми и припухлыми. После лечения блеомицином и ТА келоид на лопатках стал плоским и мягким, келоид на грудной клетке исчез. В течение следующих 2 лет наблюдения рубец оставался стабильным и не рецидивировал.
В 2020 году был проведен метаанализ эффективности лечения келоида и ГР блеомицином [6], который показал, что блеомицин был более эффективен для лечения келоидных или гипертрофических рубцов, чем другие методы лечения, включая ТА, 5-ФУ, TA в сочетании с 5-ФУ и TA в сочетании с криотерапией.
Внутрирубцовые инъекции
Для лечения келоидов и ГР изучались многие некортикостероидные внутрирубцовые инъекции и комбинированные методы лечения, включая верапамил гидрохлорид, ботулинический токсин А (БТ), гиалуронидазу и обогащенную тромбоцитами плазму (PRP)
Верапамил является блокатором кальциевых каналов, который подавляет образование молекул внеклеточного матрикса и способствует расщеплению коллагена. При лечении келоидов обычно используется в концентрации 2,5 мг / мл.
В систематическом обзоре [15] рассмотрено несколько неконтролируемых клинических исследований, где рассматривалось монолечение верапамилом или его использование в комбинации с келоидэктомией или импульсным лазером на красителе (PDL), что приводило положительному клиническому ответу.
Однако в сравнении с введением ТА, верапамил показал более слабые результаты. В двойном слепом контролируемом исследовании сравнивались монотерапия 14 келоидов верапамилом (2,5 мг / мл) и ТА (10 мг / мл) при 1 процедуре в месяц (4 процедуры). Анализ эффективности показал значительно более высокий уровень рецидива келоидных рубцов при применении верапамила по сравнению с триамцинолоном через 12 месяцев после операции и более высокий общий риск рецидива при применении верапамила (отношение рисков 8,44, 95% ДИ 1,62-44,05).
В рандомизированном контролируемом исследовании Saki и соавт. Сравнили действие: верапамила + криотерапии с TA 20 мг / мл + криотерапией; результаты показали статистически большее уменьшение роста и улучшение подвижности в группе.
Ботулинический токсин А (БТА) - нейротоксин, известный своим паралитическим действием. Его полезность при лечении келоидов может быть связана с уменьшением мышечного напряжения в местах ран и прямой регуляцией фибробластов.
Постоянное физическое напряжение операционной раны в процессе заживления продлевает воспаление и увеличивает риск образования гипертрофического рубца. Аналогичным образом, непрерывная микротравма из-за сокращения мышц в глубоких слоях кожи также может привести к образованию гипертрофических рубцов или гиперпигментации.
Инъекции БТА проводят, формируя внутрикожные или подкожные папулы вокруг рубца и непосредственно в ткани рубца. Расстояние между точками инъекций должно составлять 0,5–1 см, в каждую точку вводится 1-2 ЕД. БТА.
При расположении рубца в проекции мимических мышц лица (m.m. frontalis, corrugator, procerus, orbicularis oculi, orbicularis oris, mentalis) первоначально проводится хемоденервация мышц в технике, предусмотренной для коррекции морщин, и спустя 10– 14 дней — дополнительное инъецирование БТА в ткань рубца и в кожу вокруг него. Инъекции осуществляются с периодичностью один раз в 2–4 месяца при лечении болезненных рубцов и 1 раз в 4–6 месяцев в случае неблагоприятной клинической картины. При наличии свежих швов инъекции проводятся однократно через 3–10 дней после оперативного вмешательства, ориентируясь на степень натяжения краев раны [18].
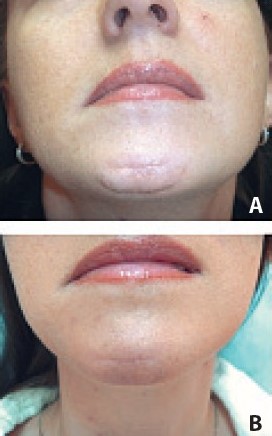
Рисунок 4 [18]. Ботулинотерапия гипертрофических рубцов: А – до процедуры, В – после курса ботулинотерапии (3 процедуры)
Интраоперационное введение ботулинического токсина в края раны может послужить профилактикой развития ГР и келоидов, так как снимает мышечное напряжение и предотвращает развитие микротравм в результате сокращения мышц.
Китайскими учеными в 2020 году было проведено проспективное двойное слепое рандомизированное клиническое исследование на пациентах, перенесших традиционную тиреоидэктомию [2]. 40 пациентов случайным образом разделили на 2 группы. Одной группе в платизму кололи 50 ЕД. «Ботокса», разведенного в 1 мл. физраствора, другой только 1 мл. физраствора. Рубцы оценивали с использованием модифицированной шкалы оценки рубцов Стоуни Брук (SBSES) и Манчестерской шкалы оценки рубцов (MSS) через 1, 12 и 24 недели после операции. Показатели SBSES и MSS в группе, получавшей «Ботокс», были значительно лучше, чем в контрольной группе (p = 0,034 и p = 0,039). Через 24 недели после операции показатели SBSES и MSS были значительно лучше в группе, получавшей «Ботокс» (p = 0,006 и p = 0,030).
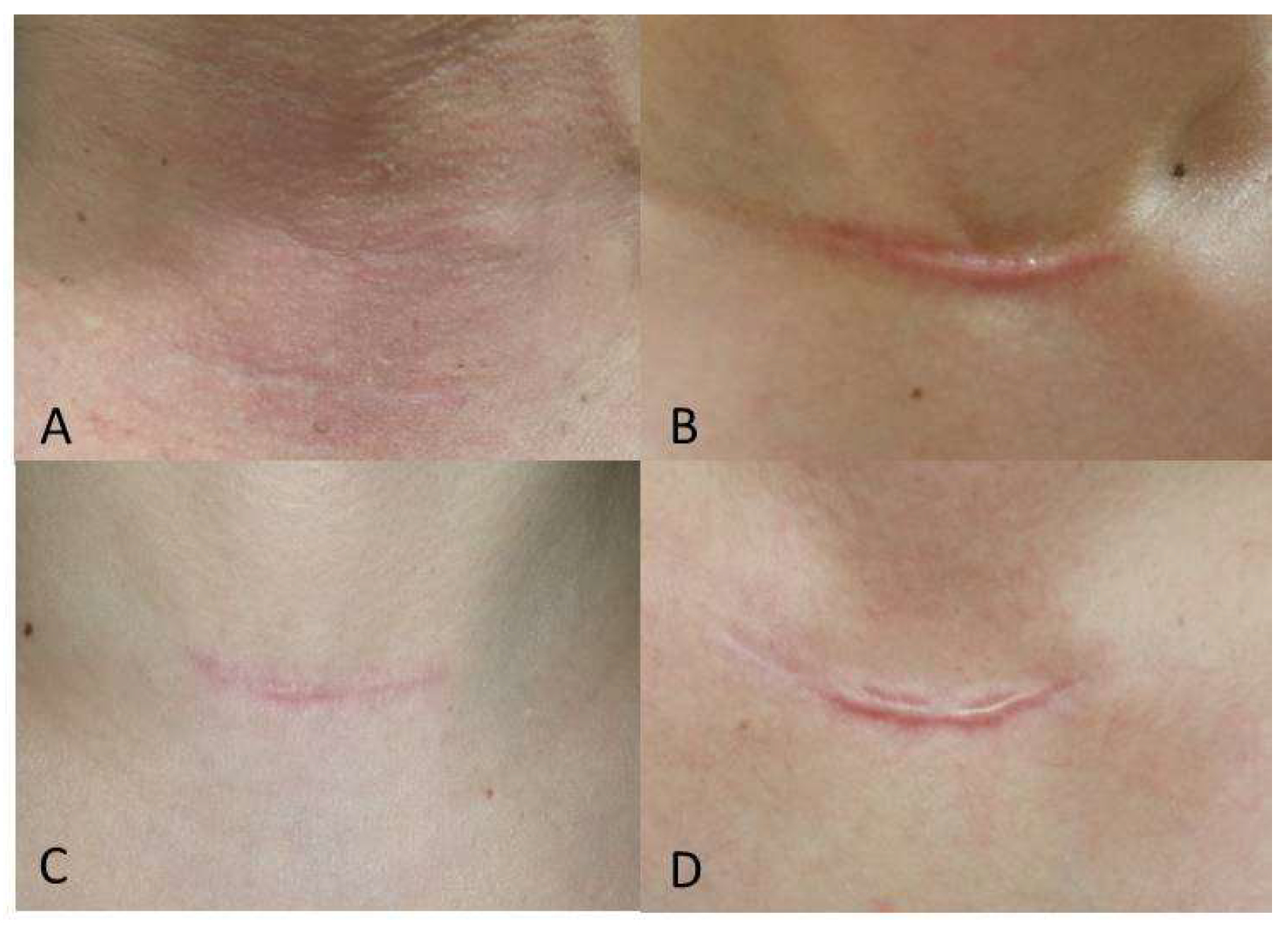
Рисунок 5 [2]. Типичные послеоперационные рубцы через 24 недели после открытой тиреоидэктомии; (A) 54-летний мужчина в группе, получавшей «Ботокс»; (B) 41-летняя женщина в контрольной группе; (C) 46-летняя женщина в группе, получавшей «Ботокс»; и (D) 54-летняя женщина в контрольной группе.
Наиболее эффективным при лечении патологических рубцов, ботулотоксин показал себя в сочетании с триамцинолона ацетонидом. Об этом свидетельствует сетевой мета-анализ 23 статей, в которых исследование проводилось на 1539 пациентах[17]. ТА + БTA значительно отличалась от эффективности монотерапии BTA, TA, 5-ФУ, верапамила и блеомицина (БTA + TA по сравнению с БTA: ОР = 2,84, 95% ДИ, 1,13–7,12; БTA + TA по сравнению с TA: ОР = 6,42, 95% ДИ, 2,88–14,31; БTA + TA по сравнению с 5-ФУ: ОР=10,25, 95% ДИ 3,99–26,34; БTA + TA по сравнению с верапамилом: ОР= 5,75, 95% ДИ 1,81–18,29; БTA + TA по сравнению с блеомицином: ОР=3,55, 95% ДИ 1,31–9,57), но эффективность БTA+ TA достоверно не отличалась от TA + 5-ФУ (ОР=0,55, 95% ДИ 0,22–1,39)
ОР – относительный риск, ДИ – доверительный интервал
Гиалуронидаза катализирует расщепление мукополисахарида гиалуроновой кислоты. Хотя ее использование при лечении келоидов изучалось, механизм ее действия четко не изучен. Aggarwal и др. показали, что совместное введение TA + 1500 МЕ / мл гиалуронидазы имело аналогичную клиническую эффективность по сравнению с применением только триамцинолона, но обладало меньшим количеством побочных эффектов (у 18,75% пациентов развилась атрофия при применении комбинации по сравнению с 31,25% пациентов при применении только триамцинолона, р < 0,001). Автор исследования подчеркивает, что в комбинированной группе дозировка TA была снижена вдвое, без потери эффективности. Velurethu et al. показали, что комбинация внутрирубцовых инъекций 5-ФУ, TA и гиалуронидазы каждые 4 недели у 50 пациентов с 60 келоидами привела к уплощению рубца у 65% пациентов и уменьшению объема на более 90% у 35% пациентов после 4 сеансов. При последующем наблюдении через 6 месяцев было отмечено только два рецидива [15].
PRP - это аутологичный концентрат тромбоцитов, который используется при различных состояниях для ускорения заживления ран, уменьшения боли и борьбы с воспалением. В клиническом исследовании Hewedy, сравнивающем золотой стандарт лечения келоидов и ГР TA в дозе 20 мг / мл каждые 3 недели в течение 4 сеансов с TA по аналогичному графику с последующей 1 инъекцией PRP, было показано, что последний обладает лучшим ответом на келоидоз и меньшим количеством побочных эффектов .
Криотерапия
Криотерапия - это известный метод, который основан на снижении температуры, вызывающем необратимое повреждение клеток. Что касается лечения келоидов, исследования показали, что криотерапия приводит келоидные фибробласты к нормальному фибробластическому фенотипу, увеличивая соотношение коллагена 3-го и 1-го типов in vitro [5.
В исследовании [2], было показано, что криотерапия выравнивает келоиды.
В исследование были включены тридцать пациентов, в том числе 12 мужчин и 18 женщин. В общей сложности 58% пациентов обратились за лечением из-за косметических проблем, 36% беспокоил зуд и 6% испытывали боль. Продолжительность изучаемых келоидных рубцов составляла от 1 до 15 лет. Толщина келоидных рубцов составляла от 0,2 до 1,6 см. После трех сеансов лечения было отмечено среднее уплощение на 30,77% с минимальным уплощением от 0% до максимального уплощения на 80%. Средняя толщина келоидных рубцов уменьшилась с исходных 0,453 см до 0,325 см. После 6 сеансов лечения среднее выравнивание увеличилось до 58,13%, а средняя толщина уменьшилась еще больше - до 0,213 см. Уплощение келоидных рубцов варьировалось от 12 до 100%.
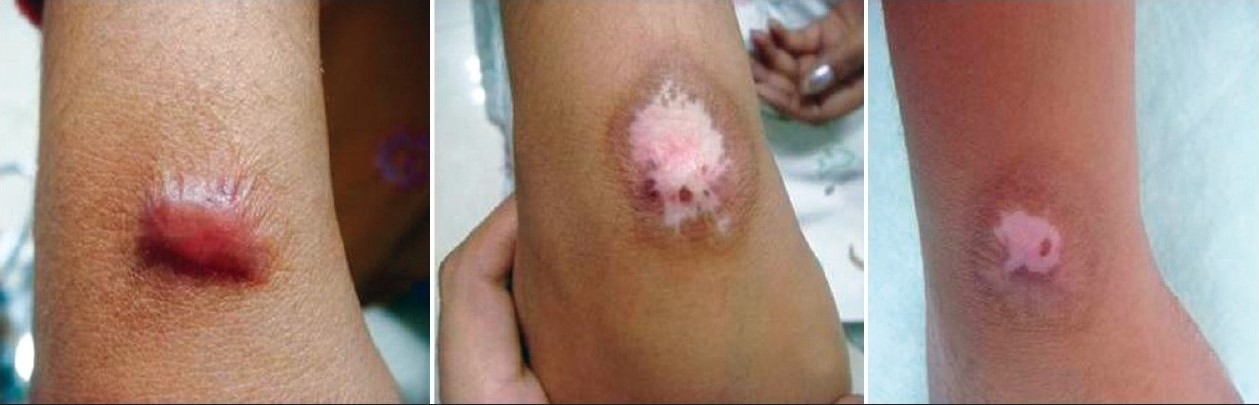
Рисунок 5 [3]. Полное уплощение келоида после 5 криосеансов.
Известным побочным эффектом криотерапии при ее применении у пациентов с более темными фенотипами кожи – это пигментные аномалии. Это связано с тем, что меланоциты разрушаются при гораздо более низкой температуре (от -4 до -8 ° C), чем фибробласты (от -30 до -40 ° C).
Во избежание данного побочного явления возможно использование внутрирубцовой криотерапии.
В систематическом обзоре [15] также приводятся сравнительные исследования криотерапии с инъекциями кортикостероидами. Так, Jannati et al. сравнивали криотерапию, с монотерапией верапамилом и совместным использованием криометодов и внутрирубцовым введением верапамила/ТА. В результате криотерапия показала значительное (p < 0,001) улучшение всех параметров VSS без каких-либо отличий от совместного применения криохирургии с TA.
Аналогичным образом, Fraccalvieri показал, что одна криотерапия или в сочетании с использованием светодиодного лазера привела к тому, что у большинства пациентов (83% из 76 пациентов) произошло уменьшение высоты келоида на 75-82%.
Небольшое исследование Careta с участием 12 испытуемых показало, что комбинация лазерного лечения, криотерапии и TA привела только к 1 рецидиву, при этом у 75% испытуемых наблюдалось значительное уменьшение толщины. В исследовании Azzam, комбинация хирургического удаления, криотерапии и PRP привела к тому, что у 70% из 50 пациентов наблюдалось уменьшение высоты келоида.
Внутрирубцовая криотерапия осуществляется с помощью игольчатого криозонда для быстрого замораживания рубца от сердцевины к краям, обеспечивая полную заморозку рубца.
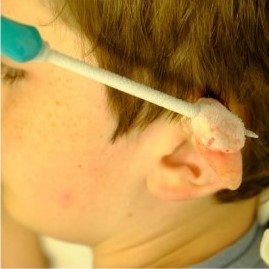
Рисунок 6 [11]. Криозонд внутри келоидного рубца во время процедуры криотерапии
Лучше всего для данного вида криотерапии подходят рубцы на тонкой ножке, так как это снижает вероятность травматизации окружающих здоровых тканей.
Криозонд подсоединен к емкости, содержащей жидкий азот. Пары азота проходят через криозонд и выходят в атмосферу через отводную трубку. Замораживание происходит быстро и может быть оценено визуально и пальпацией. Процесс продолжается до тех пор, пока весь шрам и здоровые ткани на расстоянии 5-10 мм от рубца не будут полностью заморожены.
После этого, подачу азота прекращают и дают криозонду оттаять, затем его можно удалять.
В течение недели у пациента могут наблюдаться серозно-кровянистые выделения
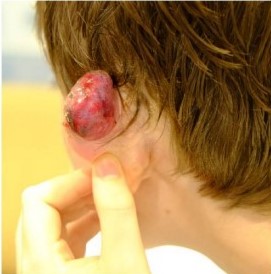
Рисунок 7 [11]. Спустя неделю после процедуры, видны серозные выделения
Через неделю выделения прекращаются и переходят в стадию сухого некроза. Через 2-8 недель струп отпадает, обнажая здоровые ткани. Спустя 3-10 недель рана затягивается.
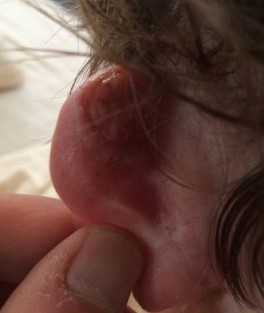
Рисунок 8 [11]. Спустя пять недель после операции
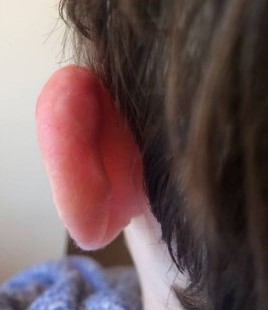
Рисунок 9 [11]. Спустя 11 недель после операции. Видно полное заживление
В обзоре [11] приведен ряд исследований лечения келоидов внутрирубцовой криотерапией.
Har-Shai et al. сообщили о среднем уменьшении объема рубца на 51-67% после однократного лечения. Эти результаты были подтверждены несколькими группами, одна из которых использовала более масштабное исследование (n = 27), в котором было обнаружено аналогичное уменьшение размера рубца (среднее уменьшение объема на 63% и площади поверхности рубца на 58,5%).
Weshahy and Ebdel Hay сообщили о среднем уменьшении объема рубца на 93,5% у 20 пациентов через четыре месяца после лечения, а Abdel-Meguid et al. из того же центра наблюдали среднее уменьшение объема рубца на 61% после внутрирубцовой криотерапии по сравнению с 23% с помощью контактной криотерапии. Однако неясно, сохранялся ли эффект в долгосрочной перспективе.
Har-Shai et al. исследовали депигментацию после конткактной и внутрирубцовой криотерапии. В группе контактной криотерапии у 91% (n = 19/21) развилась значительная депигментация, тогда как в группе, получавшей внутрирубцовую криотерапию, выраженной депигментации не наблюдалось (n = 0/24).
Нововведением во внутрирубцовой криотерапии является использование аргона вместо жидкого азота. Преимуществом является более контролируемое и точное замораживание, а также устоявшаяся история применения в области онкологии. Van Leeuwen et al. показали уменьшение объема келоидов на 62% при использовании аргона [15]. Однако, эти же авторы наблюдали более высокие показатели гипопигментации после внутрирубцовой криотерапии аргоном по сравнению с использованием жидкого азота.
Световая терапия
Лазерная терапия
Для лечения келоидов используются как абляционные, так и неабляционные лазеры. Абляционные лазеры включают эрбиевый (Er: YAG) лазер и CO2-лазер, и они вызывают локальное разрушение тканей, воздействуя на хромофоры кожи. Неабляционные лазеры, такие как неодимовые (ND:YAG), диодные лазеры и импульсные лазеры на красителях (PDL), воздействуют на меланин и/или гемоглобин. Хотя лазеры могут использоваться в качестве самостоятельной терапии келоидов и ГР, они также исследуются в сочетании с другими терапевтическими средствами. В когорте проспективных исследований обзора [15]. наиболее часто встречались статьи по CO2 лазерами, за которыми следовали эрбиевые абляционные лазеры, ND: YAG, диодные лазеры и, наконец, PDL.
В своем РКИ с участием 60 пациентов Behera et al. не обнаружено существенной разницы в терапевтическом ответе при лечении келоидов 5 сеансами CO2 лазера по сравнению с криотерапией в сочетании с TA 40 мг / мл.
Однако лазерная терапия CO2 приводила к более частым побочным эффектам на ранних стадиях. Так, проспективное исследование 41 келоида (Wang et al), показало, что после лечения лазером CO2 с последующим местным введением TA в дозе 40 мг / мл каждые 4 недели в течение 8 сеансов, частота рецидивов составил 10,5% через 24 месяца.
Garg et al аналогичным образом показали частоту рецидивов в 11,7% у пациентов, не получавших регулярные инъекции ТА, после удаления келоидов лазером CO2. К сожалению, в обзоре [15] не приводилось исследований применения CO2 лазера + TA в сравнении с монотерапией TA, что исключает прямую оценку лечения патологических рубцов CO2 лазером. Srivastava et al. [14] сравнили абляционный лазер CO2 с монотерапией TA в дозе 40 мг / мл, верапамила в дозе 2,5 мг/мл. Исследование показало, что лазер и верапамил так же эффективны, как и триамцинолонацетонид для лечения келоидных рубцов, за исключением того, что действие лазера и верапамила занимает больше времени по сравнению с TA.
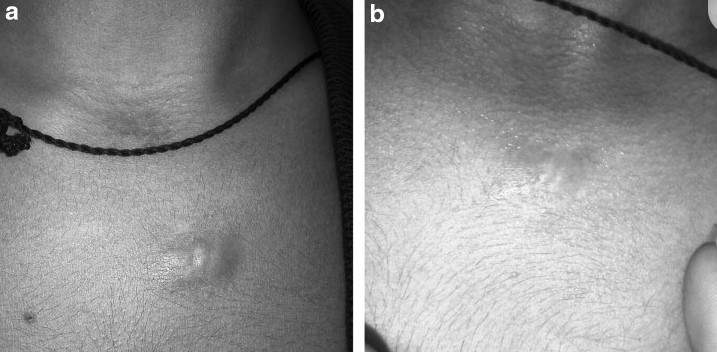
Рисунок 10 [14]. (а). Гипертрофированный рубец до лазерной терапии CO2. (б) Фотография после четырех сеансов лазерной терапии.
В параллельном контролируемом исследовании Abd El-Deyem et al. продемонстрировали преимущество фракционной абляционной доставки бетаметазона с помощью лазера Er: YAG с длиной волны 2940 нм по сравнению с введением только TA в дозе 10 мг / мл.
В другом исследовании Park JH были представлены результаты, в которых не было отмечено разницы в клиническом улучшении между келоидами, обработанными Er:YAG и TA в дозе 10 мг / мл, по сравнению с Er:YAG и дезоксиметазоновой мазью 0,25% с 3-часовой окклюзией.
Проспективное исследование Chen XE et al. 62 пациентов показало, что совместное использование 1064 нм Nd: YAG (с одним импульсом при плотности энергии 90-100 Дж/см2 и длительности импульса 12 мс) к внутрирубцовому введению «Дипроспана» (2 мг бетаметазона динатрийфосфата и 5 мг бетаметазона дипропионата в 1 мл) и 0,5 мл 5-ФУ(2,5 мг/мл) привело к значительному улучшению результатов по сравнению с любым из препаратов отдельно или в составе комплексной терапии (69% положительных ответов против 48% и 12% соответственно). Эти результаты убедительно подтверждают успешность доставки лекарств с помощью Nd:YAG. Annabathula et al. [1] изучали комбинированное действие Nd: YAG, CO2 и PDL в течение 4 недель по 5 сеансов. Фракционный CO2 лазер воздействовал с начальной энергией 10 МДж с шагом 5 МДж при каждом сеансе. Через пять минут после обработки CO2 была проведена комбинация PDL и длинноимпульсного Nd:YAG-лазера с мощностью PDL 4 Дж/см2 в 1-м сеансе с шагом 1 Дж/см2 в течение каждого сеанса, при сохранении постоянной мощности Nd:YAG на уровне 20 Дж/см2 .
У 11 пациентов, завершивших исследование, у 5 улучшение было минимальным или отсутствовало вовсе, у 4 - умеренным (26-50%), улучшение и у 2 улучшение > 50% в зависимости от размера, цвета и эстетического впечатления, произведенного тремя слепыми дерматологами.
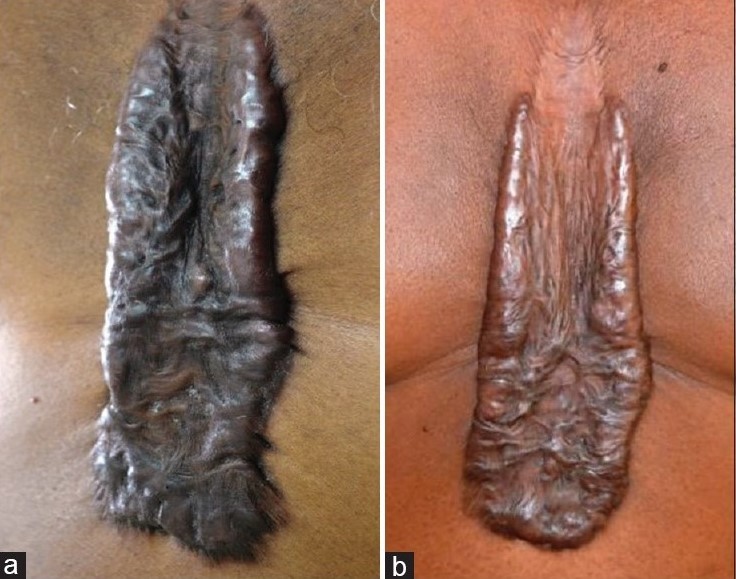
Рисунок 11 [1]. (а). Перед началом лечения. (б) После 5 сеансов терапии комбинацией лазеров.
Kassab et al. подтвердили клиническое улучшение вида келоидов в мочках ушей при лечении диодом с длиной волны 980 нм в комбинации с последующим введением TA в дозе 40 мг / мЛ каждые 3 недели в течение 2-5 сеансов.
Фотодинамическая терапия
В обзоре [15] имеются скудные данные об использовании фотодинамической терапии (ФДТ) при лечении келоидных и гипертрофических рубцов. ФДТ обычно проводится с применением фотосенсибилизирующего средства, такого как 5-аминолаэвулиновая кислота (5-АЛК). Хотя механизмы, лежащие в основе реакции келоидов на ФДТ, все еще изучаются, ФДТ является потенциальным дополнительным терапевтическим вариантом лечения патологических рубцов.
Bu et al. в 2020 году подготовили проспективное исследование, сравнивающее использование комбинации хирургического лечения и рентгенолучевой терапии с хирургией в сочетании с рентгенолучевой терапией и ФДТ в исследовании расщепленных рубцов у 10 пациентов. Оба метода лечения показали значительное уменьшение симптомов. Только болезненность 1 келоида, уменьшившаяся спустя 6 месяцев после лечения, вновь появилась после радиооблучения через 20 месяцев наблюдения. У одного из десяти пациентов через 20 месяцев произошел рецидив келоида с обеих сторон рубца. При ФДТ были отмечены побочные эффекты в виде легкой боли, а также один пузырь, образовавшийся после ФДТ. Умеренная гиперпигментация наблюдалась у 6 пациентов при 6-месячном наблюдении в обеих группах лечения с тенденцией к постепенному уменьшению к 20 месяцам наблюдения.
Huang et al. [4] усовершенствовали ФДТ, чтобы преодолеть недостатки 5-АЛК. Они оснастили ФДТ так называемыми «копьем и ножницами». В качесте «копья» выступили растворимые микроиглы на основе гиалуронидазы для доставки 5-АЛК в более глубокие слои дермы путем повреждения барьеров рогового слоя и плотного внеклеточного матрикса. «Ножницами» стал метформин, который применялся в качестве средства для вмешательства в процесс аутофагии фибробластов. Исследование фармакодинамики показало, что комбинированная терапия позволила сильно уменьшить высоту рубца, снизить экспрессию коллагена I и TGF-β1, а также снизить соотношение LC3 II/I, продемонстрировав превосходную терапевтическую эффективность.
Радиотерапия
Лучевая терапия особенно эффективна в качестве вспомогательного средства к хирургии. Метаанализ [10] 72 исследований показал, что хирургическое вмешательство в сочетании с лучевой терапией связано с меньшим количеством рецидивов (22 %), чем лучевая монотерапия (37 %).
Считается, что в основе механизма действия радиотерапии лежит снижение пролиферации фибробластов и подавление синтеза коллагена за счет снижения уровня TGF-бета и высвобождения гистамина из тучных клеток. Типичные побочные эффекты включают дисхромию и телеангиэктазии[15].
В системном обзоре [15] приводятся следующие данные:
Aluko-Olokun et al. показано, что введение TA превосходит иссечение в комбинации с радиотерапии в выравнивании лицевых келоидов. Аналогично, в исследовани Khalid et al. показали, что иссеченные келоиды, с последующим введением TA и 5-ФУ, рецидивировали у 8 из 30 пациентов по сравнению с 17 из 30 с иссеченными и впоследствии облученными келоидами через 6 месяцев. Напротив, Emad et al. обнаружили меньшее количество неудач при лечении и более высокую удовлетворенность пациентов иссечением в комбинации с радиотерапией, чем TA с криотерапией.
При лечении келоидных рубцов исследовался целый ряд доз облучения и графиков их применения, но четкого консенсуса относительно оптимальной дозы и графика нет.
Ogawa [10] приводит такую информацию. Максимальная биологически эффективная доза при келоидах составляет 30 Гр. Дозы, превышающие это количество, не повышают эффективности и только увеличивают риск вторичного канцерогенеза. Учитывая, что участки тела различаются по предрасположенности к рецидивам патологических рубцов, доза в 30 Гр не всегда необходима. В пример Ogawa приводит Nippon Medical School, работая в которой он проводит послеоперационное облучение келоидных рубцов в зависимости от участка тела: 18 Гр тремя фракциями в течение 3 дней в местах с высокой частотой рецидивов, 8 Гр одной фракцией в течение 1 дня в мочках ушей и 15 Гр двумя фракциями в течение 2 дней в других участках тела.
В более ранней статье Ogawa [9] рекомендует лучевую монотерапию длялечения пожилых пациентов или пациентов с огромными келоидами.
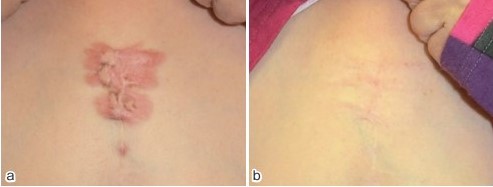
Рисунок 12 [9]. (а). Келоид на грудной клетке женщины в возрасте 70 лет лечили с помощью лучевой монотерапии.
(а) до лечения.
(б) через восемнадцать месяцев после лечения.
Этот келоид грудной стенки легкой степени тяжести лечили с помощью высокодозной поверхностной брахитерапии (25 Гр/5фр/5 дней).
Риски первичной лучевой терапии следует сопоставлять с ее огромными преимуществами: она быстро уменьшает субъективные симптомы, такие как боль и зуд, и в течение следующего года постепенно нормализует цвет и толщину рубца.
Источники:
1. Annabathula A, Sekar CS, Srinivas CR. Fractional Carbon Dioxide, Long Pulse Nd:YAG and Pulsed Dye Laser in the Management of Keloids. J Cutan Aesthet Surg. 2017 Apr-Jun;10(2):76-80. doi: 10.4103/JCAS.JCAS_136_16. PMID: 28852292; PMCID: PMC5561714.
2. Bae DS, Koo DH, Kim JE, Cho JM, Park JO. Effect of Botulinum Toxin A on Scar Healing after Thyroidectomy: A Prospective Double-blind Randomized Controlled Trial. J Clin Med. 2020 Mar 21;9(3):868. doi: 10.3390/jcm9030868. PMID: 32245256; PMCID: PMC7141531.
3. Barara M, Mendiratta V, Chander R. Cryotherapy in treatment of keloids: evaluation of factors affecting treatment outcome. J Cutan Aesthet Surg. 2012 Jul;5(3):185-9. doi: 10.4103/0974-2077.101376. PMID: 23112514; PMCID: PMC3483575.
4. Huang Y, Peng T, Hu W, Gao X, Chen Y, Zhang Q, Wu C, Pan X. Fully armed photodynamic therapy with spear and shear for topical deep hypertrophic scar treatment. J Control Release. 2022 Mar;343:408-419. doi: 10.1016/j.jconrel.2022.01.043. Epub 2022 Jan 30. PMID: 35104572.
5. Jiang ZY, Liao XC, Liu MZ, Fu ZH, Min DH, Yu XT, Guo GH. Efficacy and Safety of Intralesional Triamcinolone Versus Combination of Triamcinolone with 5-Fluorouracil in the Treatment of Keloids and Hypertrophic Scars: A Systematic Review and Meta-analysis. Aesthetic Plast Surg. 2020 Oct;44(5):1859-1868. doi: 10.1007/s00266-020-01721-2. Epub 2020 Apr 27. PMID: 32342167.
6. Kim WI, Kim S, Cho SW, Cho MK. The efficacy of bleomycin for treating keloid and hypertrophic scar: A systematic review and meta-analysis. J Cosmet Dermatol. 2020 Dec;19(12):3357-3366. doi: 10.1111/jocd.13390. Epub 2020 Apr 3. PMID: 32243056.
7. Leszczynski R, da Silva CA, Pinto ACPN, Kuczynski U, da Silva EM. Laser therapy for treating hypertrophic and keloid scars. Cochrane Database Syst Rev. 2022 Sep 26;9(9):CD011642. doi: 10.1002/14651858.CD011642.pub2. PMID: 36161591; PMCID: PMC9511989.
8. Luo QF. The combined application of bleomycin and triamcinolone for the treatment of keloids and hypertrophic scars: An effective therapy for treating refractory keloids and hypertrophic scars. Skin Res Technol. 2023 Jun;29(6):e13389. doi: 10.1111/srt.13389. PMID: 37357650; PMCID: PMC10244805.
9. Ogawa R, Dohi T, Tosa M, Aoki M, Akaishi S. The Latest Strategy for Keloid and Hypertrophic Scar Prevention and Treatment: The Nippon Medical School (NMS) Protocol. J Nippon Med Sch. 2021 Mar 11;88(1):2-9. doi: 10.1272/jnms.JNMS.2021_88-106. Epub 2020 Aug 1. PMID: 32741903.
10. Ogawa R. The Most Current Algorithms for the Treatment and Prevention of Hypertrophic Scars and Keloids: A 2020 Update of the Algorithms Published 10 Years Ago. Plast Reconstr Surg. 2022 Jan 1;149(1):79e-94e. doi: 10.1097/PRS.0000000000008667. PMID: 34813576; PMCID: PMC8687618.
11. O’Boyle CP, Shayan-Arani H and Hamada MW. Intralesional cryotherapy for hypertrophic scars and keloids: a review. Scars, Burns & Healing, Volume 3, 2017. DOI: 10.1177/2059513117702162.
12. Pan L, Qin H, Li C, Zhang G, Yang L, Zhang L. Efficacy of the Neodymium-Doped Yttrium Aluminum Garnet Laser in the Treatment of Keloid and Hypertrophic Scars: A Systematic Review and Meta-analysis. Aesthetic Plast Surg. 2022 Aug;46(4):1997-2005. doi: 10.1007/s00266-021-02716-3. Epub 2022 Jan 21. PMID: 35059813.
13. Ren Y, Zhou X, Wei Z, Lin W, Fan B, Feng S. Efficacy and safety of triamcinolone acetonide alone and in combination with 5-fluorouracil for treating hypertrophic scars and keloids: a systematic review and meta-analysis. Int Wound J. 2017 Jun;14(3):480-487. doi: 10.1111/iwj.12629. Epub 2016 Jul 18. PMID: 27427423; PMCID: PMC7949502.
14. Srivastava S, Kumari H, Singh A. Comparison of Fractional CO2 Laser, Verapamil, and Triamcinolone for the Treatment of Keloid. Adv Wound Care (New Rochelle). 2019 Jan 1;8(1):7-13. doi: 10.1089/wound.2018.0798. Epub 2019 Jan 5. PMID: 30705785; PMCID: PMC6350054.
15. Walsh LA, Wu E, Pontes D, Kwan KR, Poondru S, Miller CH, Kundu RV. Keloid treatments: an evidence-based systematic review of recent advances. Syst Rev. 2023 Mar 14;12(1):42. doi: 10.1186/s13643-023-02192-7. PMID: 36918908; PMCID: PMC10012475.
16. Worley B, Kim K, Jain-Poster K, Reynolds KA, Merkel EA, Kang BY, Dirr MA, Anvery N, Christensen RE, Hisham FI, Ibrahim SA, Asadbeigi SN, Poon E, Alam M. Treatment of traumatic hypertrophic scars and keloids: a systematic review of randomized control trials. Arch Dermatol Res. 2023 Sep;315(7):1887-1896. doi: 10.1007/s00403-023-02535-3. Epub 2023 Feb 13. PMID: 36781457.
17. Wu W, Zhao Y, Chen Y, Zhong A. Comparing the Efficacy of Multiple Drugs Injection for the Treatment of Hypertrophic Scars and Keloid: A Network Meta-Analysis. Aesthetic Plast Surg. 2023 Feb;47(1):465-472. doi: 10.1007/s00266-022-03163-4. Epub 2022 Dec 19. PMID: 36536095; PMCID: PMC9945066.
18. Тимошенко Е. В., Юцковская Я. А. Орлова О. Р. Нестандартное использование ботулинического токсина типа А: возможности профилактики образования и коррекции рубцов//Инъекционные методы в косметологии. – 2011. - №3. – С. 64-71
прочитано
9081
раз